・測定が終了したら保存ウィンドウが出てくるので、ファイル名をつけてからデスクトップ上に保存する。後でUNIX上の各自のディレクトリに保存する。
・UNIXに保存する場合は、FFFTPを使用する。詳しくは、学生実験のホームページhttp://www.rs.kagu.tus.ac.jp/~phlabex/LabExercise/index.htmlにある「FTPによるデータ転送の仕方」を見ること。
・UNIXへの保存が終了すれば、パソコンのデスクトップにある各自が作成したデータは不要になるので削除すること。バックアップが必要であれば、ネットワークに接続している実験準備室のパソコンの[学生実験]ー[実験データ]ー[格子比熱]のフォルダ内に残しておくこと。
ファイル名
一 窒素の沸点での測定の場合 → 窒素+学籍番号下3桁(窒素×××)
以下ファイル名は
ニ 混合液中での測定の場合 → 混合×××
三 時間がまだ一時間以上ある場合 → 混合_×××
四 イオン交換水+氷の共存温度での測定→ 共存×××
五 水の沸点での測定 → 水×××
”上昇温度の見積り”
実験終了後必ず毎回器具の点検、整頓、水滴の拭き取りをせよ。
本実験で用いる油回転ポンプは、電源を切ると同時に電磁リーク弁が作動するので、手動によるポンプへの大気導入は必要ない。
2.(液体窒素+エチルアルコール)混合液中での測定
3.時間がまだ1時間以上ある場合
-参考-
第2週目の実験
5.水の沸点での測定
-水の沸点の求め方(図4参照)-
気圧がH[Torr]とすると沸騰水の表面に加わる圧力Pは、
P=H+![]() [Torr] (1)
[Torr] (1)
である。h[mm]が一定になったときの圧力Pに対する水の沸点Tは、373[K]、 760[Torr]付近において、
T=373.15[K]+0.0367(P-760)[K] (2)
で与えられる。
(ただし、第二項の補正は、有効数字をよく考慮して採否を決定せよ)。
-定圧比熱Cと、定積比熱Cとの関係式-
Cp=Cv(1+γαT) (3)
ここでγはグリューナイゼン定数、αは定積膨張係数を表す。アルミニウムの場合は γ=2.17、α=6.9×10 [K ]である。
-試料の温度上昇ΔT=T-T0の求め方-
恒温壁法における熱交換の補正は、加熱前後における試料温度の時間変化を追跡して、グラフまたは計算から求める。この時間変化はニュートンの冷却の法則にしたがうと考えられるので、
T-Tf =A exp[-α’t] (4)
の曲線になるはずである。
ここでTfはt→∞としたときの終局温度とする。その決定には、
t3= ![]() (t1+t2) (5)
(t1+t2) (5)
の関係を持った時間t1、t2、t3 のそれぞれの温度T、T、T において、
![]() (6)
(6)
の関係を用いる(証明は(4)、(5)より容易にできる)。また(4)においてt=0とすれば、
A=TI ―TF
Tは供給電力を切ったときの温度とする。そして、
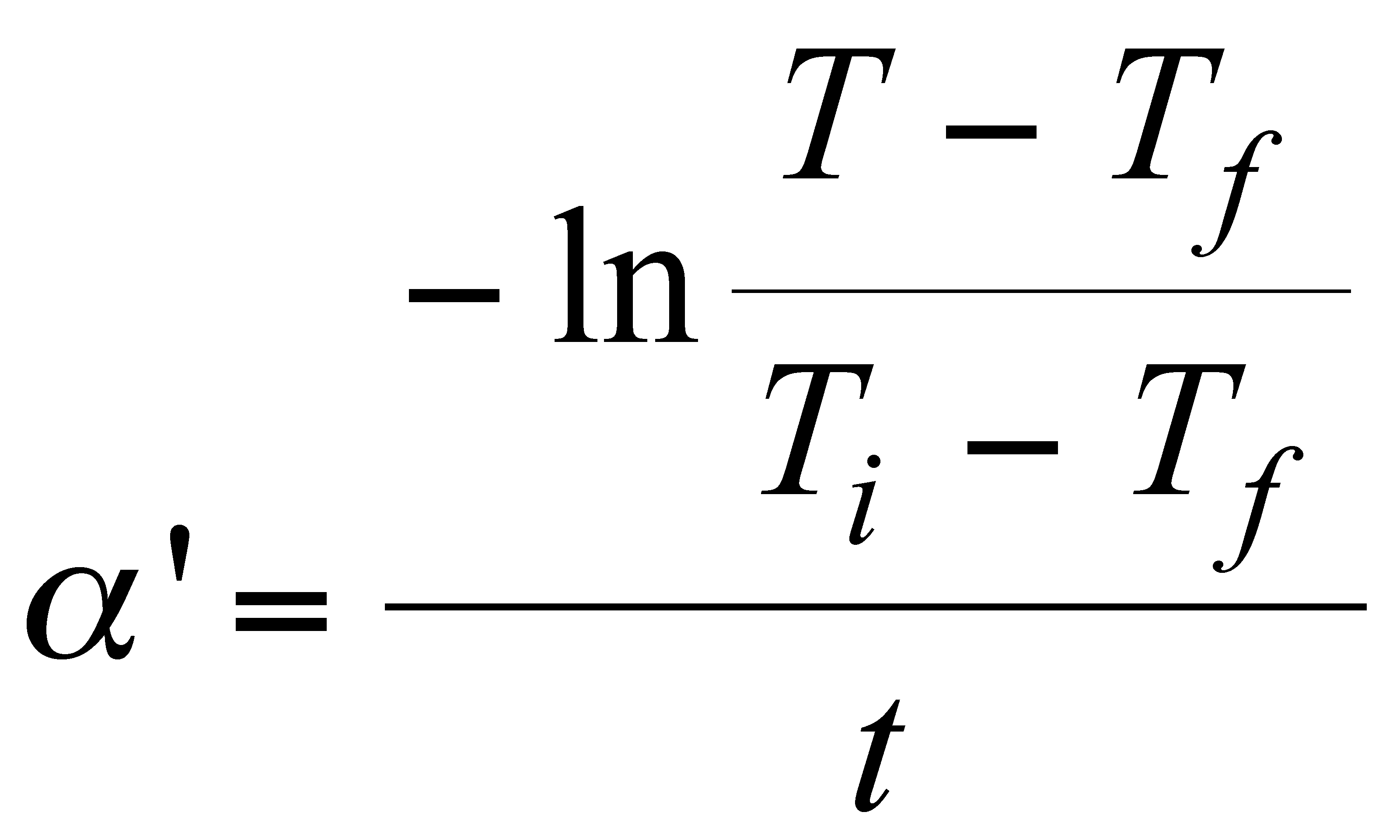 (7)
(7)
よって加熱前後の温度変化が見かけ上、一定速度で起こるものとすれば、これらを加熱期間の中点に補外して、試料の初期温度Tおよび上昇温度Tを求める。この時、t、t、tは、何通りか選択して計算。考察し、最も妥当なT、Tを求める。
すると、試料の定圧比熱は、1モルあたり
![]() (8)
(8)
で求められる。ここでV、I、tは、試料ヒーターに供給する電圧[V]、電流[A]、時間[sec]、を表し、mはモル数を表す。ここで Alの原子量は26.98154[g]、1[cal/mol]=4.1840[J・mol-1]4.1840[J・mol-1]である。
[考察]
これは、一人一人が本実験を通じて熟考した物理的内容、結果の妥当性等を論ずるもので、ユメユメ参考文献の書き移し等であってはならない。
TEXT中の問、付表、式等は考察の一助として用意したので、必ずすべてに目を通し解答せよ。
問1.(3)式のCp-Cvの関係を、熱力学的方法から導け。ただし、γはグリューナイゼンの関係式、
![]()
で表され、αは体膨張係数、Vは体積、χは圧縮率である。
問2. デュロン・プティの法則、アインシュタインの比熱理論、デバイの比熱理論の相違 を述べよ。
デバイ温度と格子の振動数の関係を具体的に述べよ。
金属の比熱には、格子比熱の他に電子比熱の寄与もあるという。双方の間の関係および温度領域の範囲を説明せよ。
測定点を滑らかな線で結び、そのCの値をもとにして液体窒素雰囲気より、水の沸点雰囲気での測定の間の、エントロピー変化
![]()
を求めよ。それを縦軸にエントロピー、横軸に絶対温度をとってグラフで示せ。
10[K]毎に計算すると、例えば窒素温度からだと
![]()
から、82Kでのエントロピー平均変化量ΔS82 [J/K]が求まる。以下、水の沸点まで同様にして計算できる。
なぜ、一般に理論ではCV、実験ではCPが用いられるのであろうか、課題2と合わせて考えてみよ。(CPについてのヒント:実験で直接Cを求めることができるだろうか?”金属の熱膨張”の解説も読んで見よ。
{参考文献}
“固体物性”の本ならば、いずれも可。
謝辞:本実験の情報処理教育の導入に当たり、元大学院生高沢章博士、水野統太氏、理数教育卒業研究生山本岳氏のご協力を得た。茲に厚く謝意を表す。